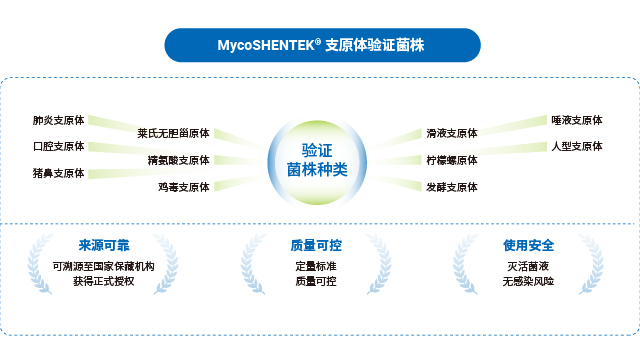
湖州申科的支原体验证菌株是支原体检测 NAT 方法验证的可靠选择,具备多重质量保障。菌株来源可靠,均取自国内外认可的合规机构验证菌株标准盘,溯源至美国模式菌种收集中心(ATCC)、中国兽医微生物菌种保藏管理中心(CVCC)等正规保藏机构,获得正式授权商用,如口腔支原体、肺炎支原体溯源至 ATCC,猪鼻支原体溯源至 CVCC。菌株生产在 BSL-2 生物安全实验室开展,符合国家生物安全法标准,针对不同菌株特性逐个优化生产工艺,涵盖超 10 种菌株的主代与工作代。质控环节严谨,采用固体平皿培养法测定 CFU(菌落形成单位),冻存前后均进行检测,确保菌落易观察分离与计数准确性;同时联合官方机构建立数字 PCR 标定方法,开展实验室间对比验证,监控 GC/CFU 比值,保障菌株活性与定量准确性,标定浓度涵盖 10CFU 和 100CFU,满足 NAT 方法验证需求。
欧洲药典2.6.7 要求测定支原体 GC/CFU 时,需同时考量上清与细胞组分,避免数据偏差。河北生物制品支原体检测验证菌株
湖州申科构建了覆盖全领域、全场景的支原体检测一站式合规解决方案。产品矩阵丰富,包括支原体 DNA 提取纯化试剂盒(2G)、检测试剂盒(2G,PCR - 荧光探针法)、DNA 校准品、一体化检测卡盒、外源因子全自动核酸分析系统,以及 10 余种支原体验证菌株(已上市猪鼻、肺炎、口腔支原体等,即将上市发酵、精氨酸支原体等)。方案具备极强的场景适配性,可应对 5% 人白、高浓度细胞等复杂基质样品,支持从起始材料到终产品的全流程检测,满足细胞疗法、抗体、疫苗、CRO/CDMO 等不同领域的检测需求。服务层面,提供从方法学建立、样品检测、适用性验证、传统法与 qPCR 法比对到特殊菌株定制的全流程技术支持,配合企业完成监管机构现场审计,满足企业从 IND 到 BLA/NDA 的申报需求,实现 “极简操作、一步加样、避免污染、全量检测” 的价值。
河北细胞疗法产品支原体检测指示细胞培养法湖州申科支原体检测试剂盒通过FDA DMF备案,支持全球药品申报使用。
湖州申科 MycoSHENTEK® 支原体检测解决方案以合规性为中心,具备突出的验证优势。该方案的试剂盒已完成 FDA 的 DMF 备案,经过 FDA 严格审核确认准确性与合规性,企业可直接引用备案信息,简化海外申报流程,降低审查不确定性,减少材料准备周期。方案通过了与合规机构的三方验证,联合合规机构获取标准菌株盘、建立 GC 比检测方法,共同开展提取效率验证、引物设计优化、反应体系与仪器程序开发,并由合规机构指导参与室间验证及检测限、专属性、耐用性等关键性能验证,严谨性与专业性获得行业认可。此外,方案还能为企业提供 NDA/BLA 申报验证支持,降低申报风险,同时涵盖试剂盒、设备、菌株、检测验证服务、现场审计等全流程服务,一站式解决企业整合成本高、流程复杂的痛点。
全球主流药典对支原体 NAT 检测的标准菌株选择形成了明确共识,中国、欧洲、美国、日本四国药典一致推荐优先使用猪鼻支原体、口腔支原体、肺炎支原体三种菌株,用于 NAT 方法检测限的验证,这一选择基于支原体的污染发生频率与进化关系。不同地区法规的验证范围略有差异:EP、USP、ChP 要求覆盖特异性、检测限、耐受性,WHO 还需包含半定量与定性实验;部分地区如欧洲药典额外纳入莱氏无胆甾原体、滑液支原体等菌株,针对昆虫和植物来源物料生产场景则需关注螺原体等特殊菌株。合规的标准菌株是 NAT 检测方法验证的前提,其溯源性与授权资质直接影响检测结果的认可度。
支原体检测中高浓度 DMSO 会抑制 PCR 反应,湖州申科通过优化样品预处理流程,有效消除该干扰。
外源因子全自动核酸检测分析系统系统在数据追溯与合规管理方面进行了针对性设计,完美适配生物药行业的严格监管要求。系统内置三级权限管理机制,可对操作人员、检测项目、数据访问进行准确管控,同时具备完善的日志审计追踪功能,详细记录检测全流程的关键信息,确保数据可追溯、可核查,完全符合 21CFR Part11 法规要求。数据传输方面,系统支持与 LIMS 实验室信息管理系统无缝对接,实现检测数据的自动同步与集中管理,同时配备 USB 接口,可直接连接打印机打印实验结果,满足企业纸质记录存档需求。这些功能让支原体检测的每一个环节都处于合规管控之下,为企业应对监管检查、保障数据真实性提供了有力支持。
支原体标准菌株在生物制药与生物检测行业中承担着关键角色,其重要性将随着生物制品的发展而愈发凸显。河北生物制品支原体检测验证菌株
湖州申科支原体检测验证菌株涵盖 10 余种,满足不同检测场景验证需求。河北生物制品支原体检测验证菌株
湖州申科外源因子全自动核酸检测分析系统打造了 “样本进、结果出” 的高效检测流程,彻底简化支原体检测操作。检测只需一步式加样,最大支持 1mL 样本直接上样,无需复杂前处理,加样后系统自动完成核酸提取与检测,全程 3 小时内即可获取结果,其中样本准备时间不足 5 分钟,检测流程只需 2.5 小时。相比传统方法水浴消化、磁珠分离、洗脱等繁琐步骤,该系统操作极大简化,且配备 UI 触屏控制系统,内置标准化程序,支持扫码启动检测,无需专业 qPCR 操作培训,普通人员经简单指导即可上手。系统采用 4 通道单独运行设计,可同步开展不同样本检测,仪器还支持叠加延展通道,进一步提升检测产能,适配生物药多批次检测需求。
河北生物制品支原体检测验证菌株