MAT 试剂盒配套的即用型细胞存在明确的传代限制,且商业化传代需获得授权,关键是保障细胞质量与检测可靠性。首先,即用型细胞经特殊工艺优化,已处于较好的活性与热原响应状态,不适合传代,传代后细胞会出现 TLR 受体表达下降、炎症因子分泌减少等问题,导致热原检测灵敏度降低,如 HL-60 细胞传代超过 5 代后,IL-6 分泌量下降 30%,无法满足检测要求。其次,若用户需将即用型细胞用于商业化生产(如大规模检测),需获得湖州申科授权,包括用户资质审核、技术培训、传代方案验证,确保用户具备细胞培养与质量控制能力,避免未经授权传代导致细胞特性改变,影响检测结果一致性。此外,参考文献数据,即使是可传代的单核细胞系,使用代次也不超过 20 代,超过后代次细胞稳定性差,因此即用型细胞设计为 “一次性使用”,从源头避免传代带来的风险。用户需严格遵守传代限制,若需长期使用,建议定期采购新批次试剂盒,确保细胞质量。
选择热原检测单核细胞活化反应测定法,即是选择更准确、更安全、更可持续的检测方案。天津热原检测流程
中国药典对 MAT 法热原检测要求 4 复孔,未明确 CV 限值,需结合细胞实验特性合理解读与操作。药典不设 CV 限值的主要原因是:MAT 法基于细胞反应,细胞活性易受环境微小变化(如温度、pH)影响,存在天然不稳定性,过严的 CV 要求可能脱离实际;但实验室可通过积累多批次数据,制定内部 CV 控制范围(如定量上下限 CV≤30%、25%),确保检测重复性。关于 3 复孔的适用性:若长期数据显示 CV 控制良好(如连续 10 批次 CV<20%),且样品为中间过程检测(非 QC 放行),可尝试 3 复孔,但需同步设置加标对照,验证结果可靠性;若为 QC 放行检测,仍建议按 4 复孔操作,符合药典下限要求。对于异常点处理,可采用狄克逊准则(Q 检验)等统计学方法 —— 如某复孔 IL-6 检测值偏离平均值 30% 以上,且无明显操作误差(如加样错误),可判定为异常点并剔除,但需在原始记录中详细说明原因,确保数据可追溯,避免随意剔除导致结果失真。
陕西原料药热原检测热原检测MAT法可在96孔板中批量检测,单批次实验1.5天即可放行,家兔法需3-7天。
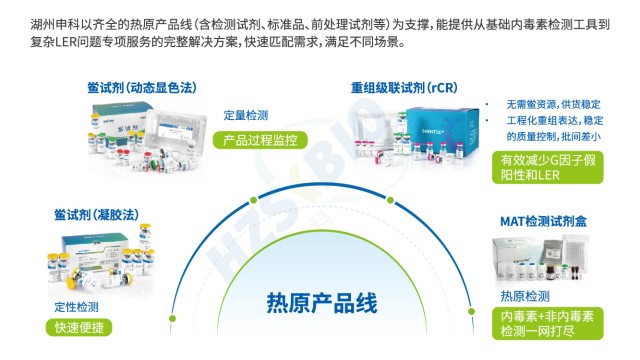
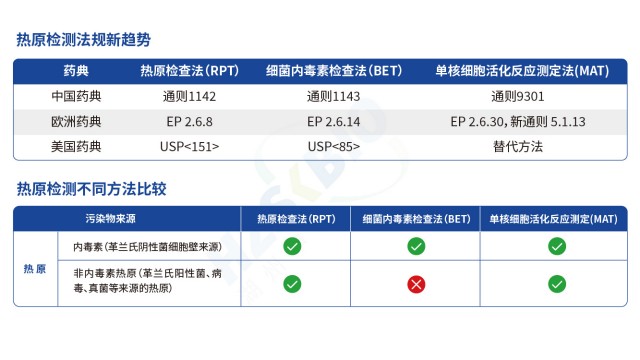
欧盟在热原检测方法选择上,以动物保护和检测准确性为导向,形成明确的法规倾向。首先,欧盟禁止家兔法(PRT 法)这类动物实验,要求采用替代方法,单核细胞活化试验(MAT 法)因符合 3R 原则(替代、减少、优化),被纳入欧洲药典(EP2.6.30),成为热原检测的主流替代方法。其次,对于鲎试剂法,欧盟虽未禁止(因其属于鲎血提取而非动物实验),但出于鲎资源保护考量,推荐使用重组 C 因子法(EP2.6.32),该方法无需依赖鲎血,通过基因工程技术制备试剂,避免资源衰减与生态争议。此外,美国药典(USP)和日本药典(JP)也同步推荐重组试剂(含重组级联试剂 rCR),形成国际法规协同趋势。需注意的是,欧盟对热原检测的要求是 “重点全场景覆盖致热物质”,MAT 法因能同时检测内毒素与非内毒素热原,重组 C 因子法因特异性高(无 G 因子干扰),均符合其法规逻辑,而传统鲎试剂法需额外关注 β- 葡聚糖假阳性问题,复杂基质样品需加做干扰验证。
一次合格的 MAT 法热原检测,需同时满足 “合格标曲” 与 “合格样品检测值及回收率” 两大关键条件。合格标曲需具备四要素:一是良好线性,采用 4-Parameter Logistic 拟合,R² 需接近 1.0,避免线性不佳导致定量偏差;二是良好信号值,各浓度点 OD 值需呈梯度变化,高浓度点 OD 值需足够(如上限浓度 OD600 达 1.0 左右),信号过低会影响灵敏度;三是良好 CV,复孔间 CV 需控制在合理范围(定量限内≤25%、定量上下限≤30%),确保重复性;四是良好背景值,阴性对照 OD 值需低于标曲下限浓度点 10%,排除外源污染。合格样品检测值则需满足加标回收率在 50%-200%,例如文档中某样品 10 倍稀释回收率 41.3%(不合格),20 倍 71.3%(接近合格),40 倍 97.7%(合格),需在 MVD 范围内调整稀释倍数,同时样品热原浓度需低于规定限值(CLC),方可判定样品符合要求。
家兔法是热原检测 “金标准”,但操作繁琐、耗时且需动物设施,存在明显局限。
含消除炎症成分的样品可能抑制 IL-6 产生,需通过科学评估排除干扰,确保 MAT 法热原检测结果准确。根据药典要求,若样品能抑制单核细胞促炎症因子释放,需通过以下步骤验证适用性:首先,选择样品 A、2A、4A 倍稀释(均不超过上限有效稀释倍数 MVD),避免高浓度消除炎症成分过度抑制;其次,进行供试品加标回收率实验,若回收率在 50%-200% 的合格范围,说明消除炎症成分未影响热原检测;再对比 “供试品配制的标曲” 与 “稀释液配制的标曲”,若两者 IL-6 检测值相差在 ±20% 以内,表明样品基质对检测无系统性干扰。例如,某消除炎症单抗样品经 2 倍稀释后,加标回收率达 120%,两种标曲 IL-6 值相差 15%,判定可适用 MAT 法。若出现回收率偏低(<50%),可尝试增加稀释倍数(如 8A 倍)或采用热灭活(若样品耐热)去除消除炎症活性;若仍无法排除干扰,需结合家兔法进行对比验证,避免因消除炎症成分导致假阴性。
一旦热原涌入人体循环系统,致热因子直抵下丘脑体温中枢,导致调定点上移、产热升散热降,体温随之飙升。陕西热原检测技术升级
凭借深厚的专业积累,湖州申科生物为行业提供可靠的热原检测解决方案。天津热原检测流程
热原是能引发恒温动物体温异常升高的物质总称,主要成分为细菌内毒素(革兰氏阴性菌脂多糖 LPS),同时涵盖病毒、真菌毒素、支原体等非内毒素热原,其检测是保障药品与医疗器械安全性的关键环节。当前热原检测已形成 “特异性检测 + 广谱筛查” 互补的完整体系:以鲎试验法(含天然 LAL 与重组 rCR/rFC 试剂)作为细菌内毒素的特异性检测手段,凭借 fg 级灵敏度成为制药行业常规质控方法,可通过凝胶法实现定性、动态浊度 / 显色法完成定量;以家兔热原试验作为传统广谱筛查方法,虽操作繁琐(需预试筛选基础体温稳定家兔,正式试验观察 3 小时体温变化),但仍是放射性质的药物、血液制品等高风险产品排除非内毒素热原的补充手段;以单核细胞活化反应测定(MAT)作为新兴全热原检测技术,利用人源单核细胞(如 THP-1 细胞)释放 IL-6、TNF-α 等细胞因子的特性,可同时识别内毒素与非内毒素热原,契合疫苗、基因治疗产品等对风险控制的需求。三种方法协同应用,从原料入厂到成品放行构建全流程热原防控网络,既保证对内毒素的准确监控,又避免非内毒素热原的遗漏风险。
天津热原检测流程