急性毒性研究通过单次高剂量给药(如口服、静脉注射),测定药物的半数致死量(LD50)或比较大耐受剂量(MTD),明确其急性毒性阈值。例如,某中枢的神经系统药物在大鼠急性毒性实验中,LD50为500mg/kg,而MTD为200mg/kg,提示临床试验起始剂量应低于100mg/kg(通常为MTD的1/2-1/3)。重复给药毒性研究则通过多剂量、长期(如28天、90天)给药,观察靶organ毒性(如肝、肾、心脏)及剂量-毒性关系。以抗纤维化药物为例,在90天重复给药毒性实验中,犬在300mg/kg/天剂量下出现肾小管坏死,而100mg/kg/天剂量下无明显异常,提示临床安全剂量应≤100mg/kg。此类研究需结合病理学(HE染色、免疫组化)和临床病理学(血常规、生化指标)分析,明确毒性靶organ及可逆性(如停药后是否恢复)。临床前实验需严谨设计,环特生物拥有标准化实验体系.湖北成都中药临床前模式动物
药代动力学(PK)研究聚焦药物在体内的吸收、分布、代谢和排泄(ADME)过程,是决定药物剂量的关键。体外实验中,Caco-2细胞模型可预测药物肠道渗透性,肝微粒体或肝细胞孵育系统则用于评估代谢稳定性。例如,某候选抗ancer药物在肝微粒体中半衰期15分钟,提示需结构优化以提高代谢稳定性。活的体PK研究依赖大鼠或犬模型,通过液相色谱-质谱联用技术(LC-MS)测定血浆、组织中的药物浓度。环特生物开发的斑马鱼PK模型,可实时观察药物在胚胎体内的分布,发现某化合物在脑部的蓄积量是血浆的3倍,提示其可能穿透血脑屏障。PK/PD(药效动力学)整合分析进一步关联药物浓度与疗效,例如在antibiotic研发中,通过PK模型确定给药间隔,使血药浓度维持在小抑菌浓度(MIC)以上,显著提高杀菌效果。临床前安全性评价服务临床前模型构建技术,是环特生物的主要竞争优势之一。

基因医疗药物作为前沿的生物药,其临床前研究面临更高的技术要求与安全标准。杭州环特生物科技股份有限公司凭借专业的技术平台,为基因医疗药物研发提供定制化的临床前研究服务。临床前研究需重点关注基因编辑工具的特异性、安全性与有效性,通过斑马鱼模型、哺乳动物模型评估基因编辑对正常细胞的影响,避免脱靶效应引发的风险;同时,需验证基因医疗药物的递送效率与靶向性,确保药物能精细到达病灶部位发挥作用。此外,临床前研究还需建立完善的生物分布与代谢检测体系,明确药物在体内的代谢路径与蓄积情况。环特生物严格遵循国际国内相关指导原则,为基因医疗药物的临床前研究提供合规、可靠的数据支持,助力该类药物的临床转化。
近年来,技术融合推动了小分子药物临床前研究的革新。人工智能(AI)在靶点预测、化合物筛选中发挥关键作用,例如DeepMind的AlphaFold2预测蛋白质结构,加速了靶点发现;生成对抗网络(GAN)设计新型分子骨架,将先导化合物优化周期缩短60%。类organ与器官芯片(Organ-on-a-Chip)技术模拟人体微环境,提高药效学与毒理学评价的临床相关性。例如,肺类organ可重现入侵过程,用于筛选抗病毒药物;肝脏芯片则动态监测药物代谢产物对肝细胞的损伤。此外,3D生物打印技术构建复杂组织模型,如tumor血管化模型,可评估药物对tumor微环境的调控。这些创新技术使临床前研究从“经验驱动”转向“数据驱动”,明显提升了研发效率与成功率。环特生物的临床前服务覆盖药物安全性与有效性评价。
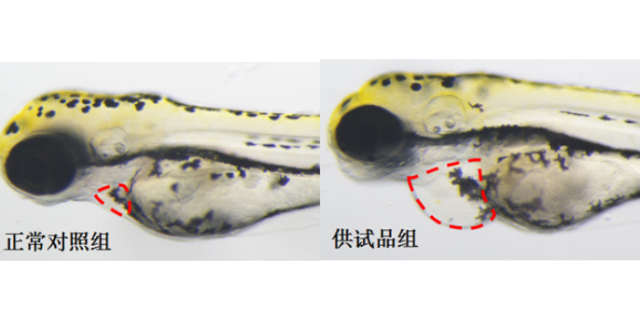
眼部药物研发因眼部结构的特殊性,对临床前研究模型提出了更高要求,精细的模型是保障临床前研究效果的关键。杭州环特生物科技股份有限公司针对眼部疾病的特点,构建了专属的临床前研究模型体系,包括斑马鱼眼部疾病模型、哺乳动物眼部模型等。在临床前药效评价中,斑马鱼眼部结构透明的特点可直观观察药物对眼部组织的作用效果,例如在视网膜病变药物研究中,实时监测药物对视网膜细胞的保护作用;哺乳动物模型则可更贴近人体眼部生理环境,验证药物的长期疗效与安全性。此外,临床前研究还需开展眼部刺激性测试,确保药物对眼表无损伤。环特生物的临床前研究模型体系,为眼部药物研发提供了精细、高效的工具,加速了眼部疾病医疗药物的研发进程。临床前实验助力保健食品研发,环特生物提供功效验证。化合物临床前安评实验
选择环特生物的临床前服务,为新药研发筑牢坚实基础。湖北成都中药临床前模式动物
动物毒理实验是化合物临床前研究中保障安全性的关键环节。实验需选用合适的动物模型,如大鼠、小鼠、豚鼠等,根据化合物预期的临床用途和给药途径,设计不同剂量组进行长期或短期给药。期间密切观察动物的一般行为表现、体重变化、饮食情况等,定期采集血液、组织样本进行血常规、血生化、病理组织学检查。例如,通过长期毒性实验,可发现化合物对动物肝脏、肾脏、心脏等重要organ是否造成损伤及损伤程度,确定其无毒性反应剂量和比较大耐受剂量。急性毒性实验则能快速评估化合物单次大剂量给药后的毒性反应,如是否引发急性死亡、惊厥等严重不良反应。这些毒理实验数据为确定化合物在人体临床试验中的安全起始剂量和剂量递增方案提供重要参考,很大程度降低人体用药风险。湖北成都中药临床前模式动物